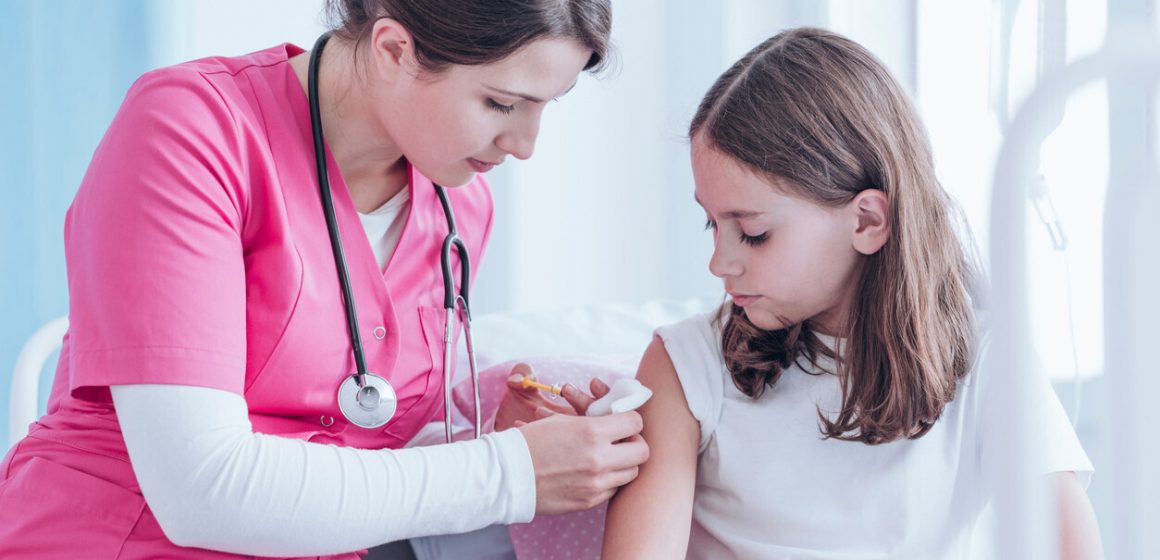
Estados Unidos. La Administración de Alimentos y Medicamentos (FDA) de Estados Unidos se está preparando para autorizar el uso de la vacuna Pfizer-BioNTech Covid-19 en adolescentes de 12 a 15 años a principios de la próxima semana, según funcionarios federales familiarizados con los planes de la agencia, lo que abre la campaña de vacunación del país a millones de estadounidenses más.
El anuncio se esperaba desde que Pfizer dio a conocer los resultados de su ensayo en adolescentes, que demuestra que la vacuna es al menos tan efectiva en ese grupo de edad como en los adultos.
La vacunación de los menores también es clave para aumentar el nivel de inmunidad en la población y reducir el número de hospitalizaciones y muertes.
La autorización podría llegar incluso a fines de esta semana, según los funcionarios federales, que no dieron sus nombres porque no estaban autorizados a hablar en público.
Si se concede, el panel asesor de vacunas de los Centros para el Control y la Prevención de Enfermedades probablemente se reunirá al día siguiente para revisar los datos del ensayo clínico y hacer recomendaciones para el uso de la vacuna en adolescentes.
Pfizer informó hace varias semanas que ninguno de los adolescentes del ensayo clínico que recibieron la vacuna desarrolló infecciones sintomáticas, un signo de protección significativa.
La compañía anunció a fines de marzo que los voluntarios produjeron fuertes respuestas de anticuerpos y experimentaron aproximadamente los mismos efectos secundarios observados en personas de 16 a 25 años.
Stephanie Caccomo, portavoz de la Administración de Alimentos y Medicamentos, dijo que no podía comentar sobre la decisión de la agencia.
“Podemos asegurarle al público que estamos trabajando para revisar esta solicitud de la manera más rápida y transparente posible”, dijo.
Más de 100 millones de adultos del país ya han sido vacunados por completo. Pero la autorización llegaría en medio de un empujón para llegar al 44 por ciento de los adultos que hasta ahora han dudado en recibir una vacuna o no han tenido acceso a una. Plantean dilema ético por acumulaciónCon gran parte del mundo clamando por un exceso de suministro de vacunas fabricadas en Estados Unidos, el uso de la inyección de Pfizer-BioNTech en adolescentes también podría plantear preguntas sobre si el suministro debe estar dirigido a un grupo de edad que hasta ahora parece estar mayormente a salvo de un episodio severo de Covid-19.
“Creo que necesitamos tener una conversación nacional y mundial sobre la ética de vacunar a los niños que tienen bajo riesgo de complicaciones graves por el virus cuando no hay suficientes vacunas en el mundo para proteger a los adultos de alto riesgo de morir”, dijo. Jennifer Nuzzo, epidemióloga del Johns Hopkins Center for Health Security.
El Presidente Biden se ha visto sometido a una presión cada vez mayor para que entregue parte del suministro de vacunas del país, e incluso dentro del Gobierno federal, algunos funcionarios han instado a la administración a decidir pronto cuántas vacunas se necesitan, para que las dosis caduquen o se envíen a los estados y no se utilicen.
El Gobierno federal compró 700 millones de dosis de tres vacunas autorizadas por el Gobierno federal que se entregarán antes de fines de julio, mucho más de lo que se necesitaría para cubrir a todos los estadounidenses.
El suministro actual de vacunas del país es sustancial. Hasta el lunes, se habían enviado pero no administrado alrededor de 65 millones de dosis, incluidas 31 millones de dosis de la vacuna de Pfizer-BioNTech, casi 25 millones de dosis de Moderna y 10 millones de dosis de Johnson & Johnson, según las cifras recopiladas por los Centros para el Control y Prevención de Enfermedades. Tanto las vacunas de Pfizer como las de Moderna requieren dos dosis.
Se han fabricado decenas de millones más de dosis de Pfizer-BioNTech, alrededor de tres semanas, según un funcionario federal, y se encuentran en varias etapas de preparación, a la espera de someterse a las pruebas finales antes de ser enviadas.
Moderna espera resultados pronto de su propio ensayo clínico con adolescentes de 12 a 17 años, seguido de resultados para niños de 6 meses a 12 años en la segunda mitad de este año.